Fluoresenssiresonanssienergian siirto (FRET)
Fluoresenssiresonanssienergian siirto (FRET) on ei-säteilyenergian siirtoprosessi, jossa luovuttajan virittyneen tilan energia siirtyy akseptoriviritystilaan molekyylien välisten sähköparien vuorovaikutuksen kautta.Tämä prosessi ei sisällä fotoneja, joten se ei ole säteilyä.Tämän määrityksen etuna on nopea, herkkä ja yksinkertainen.
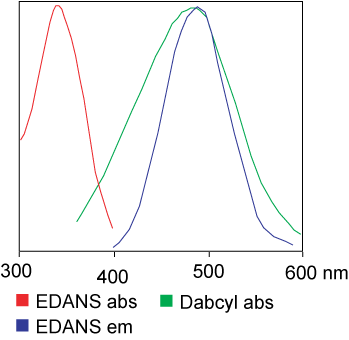
FRET-määrityksessä käytetty väriaine voi olla identtinen.Mutta useimmissa sovelluksissa käytetään itse asiassa erilaisia värejä.Lyhyesti sanottuna valoresonanssienergian siirto on dipoliparin siirtymistä luovuttajalta (väriaine 1) vastaanottajalle (väriaine 2), kun luovuttajaryhmä on virittynyt.Yleensä Donor-fluoroforiryhmän emissiospektri on päällekkäinen Acceptor-ryhmän absorptiospektrin kanssa."Kun kahden fluoroforin välinen etäisyys on sopiva (10 - 100 A), voidaan havaita fluoroforin energian siirtyminen luovuttajalta vastaanottajalle."Energiansiirtomenetelmä riippuu reseptorin kemiallisesta rakenteesta:
1. Muuntuu molekyylivärähtelyksi, eli energiansiirron valovalo katoaa.(Reseptori on valon sammuttaja)
2. Emissio on voimakkaampaa kuin itse reseptori, mikä johtaa punasiirtymään toissijaisessa fluoresenssispektrissä.(Reseptorit ovat valosäteilijöitä).
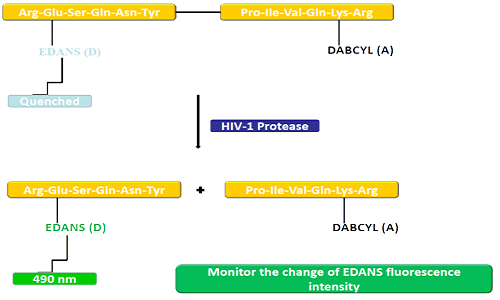
Luovuttajaryhmä (EDANS) ja akseptorigeeni (DABCYL) on kytketty tasaisesti HIV-proteaasin luonnolliseen substraattiin, ja kun substraattia ei ole irrotettu, DABCYL voi sammuttaa EDANSin ja tulla sitten havaitsemattomaksi fluorille.HIV-1-proteaasin katkaisun jälkeen DABCYL ei enää sammuta EDANS:ia, ja EDANS-lusiferaasit voidaan myöhemmin havaita.Proteaasi-inhibiittoreiden saatavuutta voidaan seurata EDANSin fluoresenssin intensiteetin muutoksilla.
FRET-peptidit ovat käteviä työkaluja peptidaasien epäspesifisyyden tutkimiseen.Koska sen reaktioprosessia voidaan seurata jatkuvasti, se tarjoaa kätevän menetelmän entsyymiaktiivisuuden havaitsemiseksi.Luovuttajan/akseptorin peptidisidosten hydrolyysin jälkeen tuottama kiilto antaa mittaa entsyymiaktiivisuudesta nanomolaarisilla pitoisuuksilla.Kun FRET-peptidi on ehjä, se osoittaa äkillisen sisäisen välähdyksen katoamisen, mutta kun mikä tahansa luovuttajaa/akseptoria vastapäätä oleva peptidisidos katkeaa, se vapauttaa välähdyksen, joka voidaan havaita jatkuvasti ja entsyymiaktiivisuus voidaan sitten kvantifioida.
Postitusaika: 14.8.2023