Aminohapon ja sokerin yhdistämistavan mukaan sokeripeptidi voidaan jakaa neljään kategoriaan: O-glykosylaatio, CaN-glykosylaatio, kasteen sokerointi ja GPI (glykofosfatidlyinositoli) -yhteys.
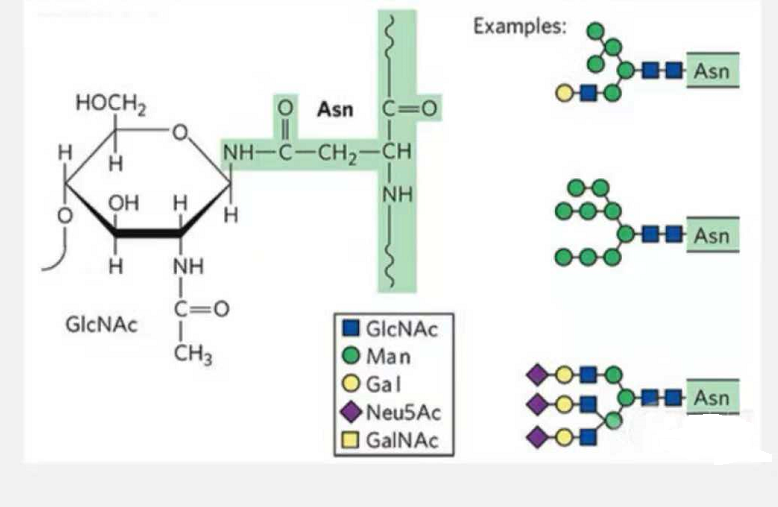
1. N-glykosylaatioglykopeptidit koostuvat N-asetamidiglukoosista glykaaniketjun pelkistävässä päässä (Glc-Nac), joka on kytketty N-atomiin peptidiketjun jonkin Asn:n sivuketjun amidiryhmässä, ja Asn:sta. Yhdistämään glykaaniketjun on sijaittava AsN-X-Ser/Thr:ssä (X! =P) tähteiden muodostamassa motiivissa.Sokeri on N-asetyyliglukosamiini.
N-glykosylaatiomodifioitu rakenteellinen glykopeptidi
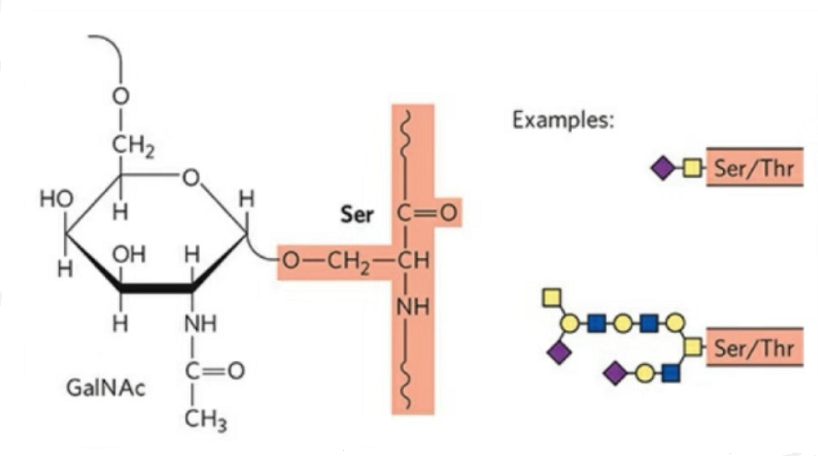
2. O-glykosylaation rakenne on yksinkertaisempi kuin N-glykosylaation.Tämä glykopeptidi on yleensä lyhyempi kuin glykaani, mutta siinä on enemmän tyyppejä kuin N-glykosylaatio.Ser ja Thr voivat yleensä olla glykosyloituneita peptidiketjussa.Lisäksi on glykopeptidejä, jotka on koristeltu tyrosiini-, hydroksyyli- ja hydroksiproliiniglykosylaatiolla.Linkkiasema on hydroksyylihappiatomi jäännöksen sivuketjussa.Kytketyt sokerit ovat galaktoosi tai N-asetyyligalaktosamiini (Gal&GalNAc) tai glukoosi/glukosamiini (Glc/GlcNAc), mannoosi/mannosamiini (Man/ManNAc) jne.
O-glykosylaatio muuttaa rakennetta
3. Glykopeptidi O-GlcNAC glykosylaatio ((N-asetyylikysteiini (NAC)) (glcnAcN-asetyyliglukosamiini/asetyyliglukosamiini)
Yksittäinen N-asetyyliglukosamiinin (GlcNAc) glykosylaatio yhdistää proteiinit O-GlcNAc proteiinin seriini- tai treoniinitähteen hydroksyylihappiatomiin.O-GlcNA-glykosylaatio on O-GlcNAc-monosakkaridiornamentti ilman glykaanin pidentämistä;Kuten peptidifosforylaatio, myös glykopeptidien O-GlcNAc-glykosylaatio on dynaaminen proteiinien koristeluprosessi.Epänormaali O-GlcNAc-koristelu voi aiheuttaa erilaisia sairauksia, kuten diabetesta, sydän- ja verisuonitauteja, kasvaimia, Alzheimerin tautia ja niin edelleen.
Glykopeptidien glykosylaatiopisteet
Polypeptidien ja sokeriketjujen perusrakenteet on liitetty proteiiniketjuihin kovalenttisilla sidoksilla, ja sokeriketjuja yhdistäviä kohtia kutsutaan glykosylaatiopaikoiksi.Koska glykopeptidisokeriketjujen biosynteesiä seuraamaan ei ole templaattia, eri sokeriketjut kiinnittyvät samaan glykosylaatiokohtaan, mikä johtaa niin kutsuttuun mikroskooppiseen epähomogeenisuuteen.
Glykopeptidien glykosylaatio
1. Glykopeptidiglykosylaation vaikutus terapeuttisten proteiinien terapiatehokkuuteen
Terapeuttisten proteiinien tapauksessa glykosylaatio vaikuttaa myös proteiinilääkkeiden puoliintumisaikaan ja kohdentamiseen in vivo
2. Liukoisen glykopeptidin glykosylaatio ja proteiinit
Tutkimukset ovat osoittaneet, että proteiinien pinnalla olevat sokeriketjut voivat parantaa proteiinien molekyyliliukoisuutta
3. Glykopeptidiglykosylaatio ja proteiinien immunogeenisyys
Toisaalta proteiinien pinnalla olevat sokeriketjut voivat indusoida spesifisiä immuunivasteita.Toisaalta sokeriketjut voivat peittää tiettyjä pintoja proteiinin pinnalla ja vähentää sen immunogeenisyyttä
4. Glykopeptidiglykosylaatio, joka lisää proteiinin stabiilisuutta
Glykosylaatio voi lisätä proteiinien stabiilisuutta erilaisissa denaturaatioolosuhteissa (kuten denaturointiaineet, lämpö jne.) ja välttää proteiinien aggregoitumista.Samalla proteiinien pinnalla olevat sokeriketjut voivat peittää myös joitain proteiinimolekyylien proteolyyttisiä hajoamispisteitä, mikä lisää proteiinien vastustuskykyä proteinaaseja vastaan.
5. Glykopeptidiglykosylaatio, joka vaikuttaa proteiinimolekyylien biologiseen aktiivisuuteen
Proteiinin glykosylaation muuttaminen voi myös mahdollistaa proteiinimolekyylien muodostavan uusia biologisia aktiivisuuksia
Postitusaika: 03.08.2023